近日,湘雅科研团队取得了多项突破。敲黑板!一起看看2025年5月的科研成果吧~
以下成果根据湘雅各二级学院、附属医院官网等整理。
刘劲芳团队在国际期刊发表缺血性脑卒中治疗新策略
近日,中南大学湘雅医院神经外科-脑外伤与神经重症亚专科主任刘劲芳教授团队在国际权威期刊《Journal of Nanobiotechnology》(《纳米生物技术杂志》,IF10.6)发表原创性研究论文,首次阐明M2型小胶质细胞来源的小细胞外囊泡(M2-sEVs)通过iR-25-3p/miR-93-5p-TGFBR/PTEN/FOXO3轴调控神经干细胞(NSC)命运,显著促进缺血性脑卒中后神经功能恢复。

研究显示,在动物模型中,M2-sEVs治疗使脑梗死体积减少,并显著改善运动与感觉功能评分,长期神经功能恢复效果显著;同时,M2-sEVs通过递送miR-25-3p和miR-93-5p,靶向抑制TGFBR、PTEN和FOXO3表达,激活神经干细胞增殖与神经元定向分化,同时抑制胶质瘢痕形成。团队成员认为,或可突破当前脑卒中后神经再生不足的治疗瓶颈。此项成果为缺血性脑卒中、创伤性脑损伤等中枢神经系统损伤疾病的治疗开辟了新方向。研究团队表示,下一步将探索M2-sEVs规模化制备工艺及临床前安全性评估,加速其向临床应用转化。
论文链接:https://doi.org/10.1186/s12951-025-03390-2
张隆伯团队在国际顶尖期刊《Brain》发表研究成果
近日,《Brain》(《脑》,IF:16.17)杂志刊登了中南大学湘雅医院神经外科张隆伯教授团队题为《Filamin A in focus: unraveling the multifaceted roles of FLNA in neurodevelopment and neurological disorders》(聚焦FLNA:揭示FLNA在神经发育和神经系统疾病中的多重作用)的综述文章。该文系统回顾了Filamin A(FLNA)在神经发育中的多重功能,涵盖神经元迁移、树突与轴突生长、突触形成、机械转导及信号整合等关键生物过程。文章指出,FLNA不仅作为细胞骨架的支架分子,更是连接细胞结构与信号传导的关键平台。其表达异常与多种神经发育障碍密切相关,包括室管膜旁结节异位(PVNH)、局灶性皮质发育异常(FCD)、结节性硬化症(TSC)及孤独症谱系障碍(ASD)。该综述亦深入探讨了FLNA作为潜在治疗靶点的研究基础与转化前景。

论文链接:https://doi.org/10.1093/brain/awaf180
吴畏、尹继业、陈永恒教授团队在《Drug Resistance Updates》发表肿瘤基因毒性药物耐药新机制的研究成果
近日,中南大学湘雅医院老年外科/国家老年疾病临床医学研究中心吴畏教授、临床药理研究所尹继业研究员和国家卫健委肿瘤蛋白质组学重点实验室陈永恒教授团队在国际著名期刊《Drug Resistance Updates》(《药物耐药进展》,中科院1区,IF:15.8)以原创论著形式在线发表题为 “CSDE1 enhances genotoxic drug resistance in cancer by modulating RPA2 through CSDE1-eIF3a regulatory complex”(“CSDE1通过CSDE1-eIF3a调控复合物调节RPA2增强癌症的基因毒性药物耐药性”)的原创研究性论文。该研究基于癌症患者临床样本发现一种RNA结合蛋白CSDE1与基因毒性药物敏感性显著相关,通过形成"CSDE1-eIF3a-RPA2"拉链式三元复合物发挥核心作用,为提升基因毒性药物敏感性提供了新靶点。

本研究通过分析药物敏感性差异的癌症患者临床样本,首次发现基因毒性药物耐药患者肿瘤中冷休克结构域蛋白E1(CSDE1)的表达显著升高。进一步研究表明,CSDE1的高表达能够激活DNA损伤修复通路,在肿瘤细胞中促进耐药性。在X射线或博来霉素诱导的DNA损伤小鼠模型中,系统性敲除CSDE1导致DNA损伤显著增加。对机制进行深入探讨发现,CSDE1可以上调RPA2翻译水平激活DNA损伤修复通路,在抑制DNA损伤的同时减少基因组DNA碎片形成,进而通过削弱cGAS-STING通路活性促进肿瘤细胞存活。该研究还鉴定出CSDE1发挥作用的结构基础,即CSDE1-蛋白(eIF3a)-RNA(RPA2)三元复合物,并解析了其结构特征。这项研究首次揭示了CSDE1在增强基因毒性药物耐药性中的作用,CSDE1抑制剂与基因毒性药物联用可能成为一种有前景的肿瘤联合疗法。
原文链接:https://authors.elsevier.com/sd/article/S1368-7646(25)00050-0
黎志宏、涂超团队发表论文揭示了PKMYT1通过调控NPM1 S260介导的DNA损伤修复影响骨肉瘤顺铂敏感的新机制
近日,中南大学湘雅二医院黎志宏教授、涂超副研究员团队在国际权威学术期刊《Signal Transduction and Targeted Therapy》(IF:40.8)发表题为“PKMYT1 kinase ameliorates cisplatin sensitivity in osteosarcoma”的研究,该研究揭示了PKMYT1通过调控NPM1 S260介导的DNA损伤修复影响骨肉瘤顺铂敏感的新机制,并提出新的联合治疗策略。

骨肉瘤(Osteosarcoma, OS)是儿童和青少年中最常见的原发性恶性骨肿瘤,顺铂(DDP)是其化疗核心药物,但耐药问题导致临床疗效受限,患者5年生存率仅60%-70%。因此,寻找调控骨肉瘤顺铂敏感性的关键靶点并深入解析相关机制,是提升骨肉瘤治疗效果的关键科学问题。CRISPR筛选作为一种高通量技术,已被广泛应用于耐药机制及相关候选基因的研究,蛋白激酶因其在癌症的生长、转移及耐药过程中的重要调控作用,也逐渐成为研究重点。然而,目前尚缺乏利用CRISPR筛选系统性探讨调控骨肉瘤顺铂敏感性相关激酶的研究。
该研究通过全激酶组CRISPR文库筛选结合转录组测序,鉴定出PKMYT1为调控骨肉瘤顺铂敏感性的关键因子。体内外实验证实,敲除PKMYT1可显著增强骨肉瘤细胞对顺铂治疗的敏感性。分子机制研究表明,PKMYT1可与NPM1直接结合,并诱导其S260位点的磷酸化修饰,随后竞争性抑制NPM1 SUMO化,影响NPM1对DNA修复因子BRCA1、RAP80、RAD51的招募,导致同源重组修复效率和同源末端连接修复效率改变,最终影响骨肉瘤对顺铂的敏感性变化。最后,体外实验及患者来源类器官模型证明PKMYT1抑制剂RP6306与顺铂联合应用具有协同杀伤骨肉瘤细胞的作用。研究成果将为骨肉瘤治疗、化疗增敏提供新的思路和方向。
黎志宏、许浩东、涂超团队在高水平期刊《Nucleic Acids Research》发表激酶耐药研究成果
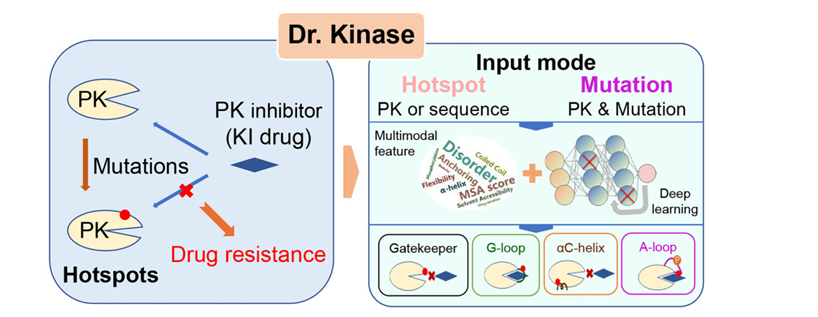
近日,中南大学湘雅二医院黎志宏教授、许浩东教授团队联合国内外多家科研机构,在国际高水平期刊《Nucleic Acids Research》(IF:16.7)在线发表了题为“Dr. Kinase: predicting the drug-resistance hotspots of protein kinases”的研究论文。该研究构建了创新型的人工智能平台Dr. Kinase,实现了对蛋白激酶四类重要耐药区域的精准预测,填补了激酶耐药机制研究和临床靶向药物开发中的重要空白。

蛋白激酶(Protein Kinases)在细胞信号转导中发挥核心调控作用,已成为多种肿瘤治疗的重要靶点。尽管靶向激酶的小分子抑制剂已在临床取得突破性进展,但耐药突变的广泛存在严重限制了其长期疗效。针对这一临床难题,黎志宏团队整合蛋白序列、结构和进化等多模态信息,提出Dr. Kinase深度混合学习模型,对Gatekeeper、G-loop、aC-helix和A-loop四类重要激酶耐药区域进行精准识别,并在独立测试集中表现出卓越的泛化能力。Dr. Kinase不仅支持耐药区域预测,还可评估任意位点突变对激酶结构和药物结合能力的影响,为新型靶向药物的设计与筛选提供理论支撑。通过Dr. Kinase,研究团队还鉴定出超过1000个潜在的激酶抑制剂的耐药事件,进一步验证了该其在临床前药物开发与精准医学中的转化潜力。目前,Dr. Kinase已上线成为免费开放的预测系统(http://modinfor.com/drkinase),面向全球科研人员提供服务。
董政、蔡娟团队揭示抑制p53通过维持PGC1α和线粒体稳态促进肾脏修复
近日,中南大学湘雅二医院肾内科的董政/蔡娟团队在肾脏领域知名期刊Kidney International(中科院一区,IF: 14.8)上发表题为"Repression of peroxisome proliferation-activated receptorγcoactivator-1αby p53 after kidney injury promotes mitochondrial damage and maladaptive kidney repair”的原创性研究论文。
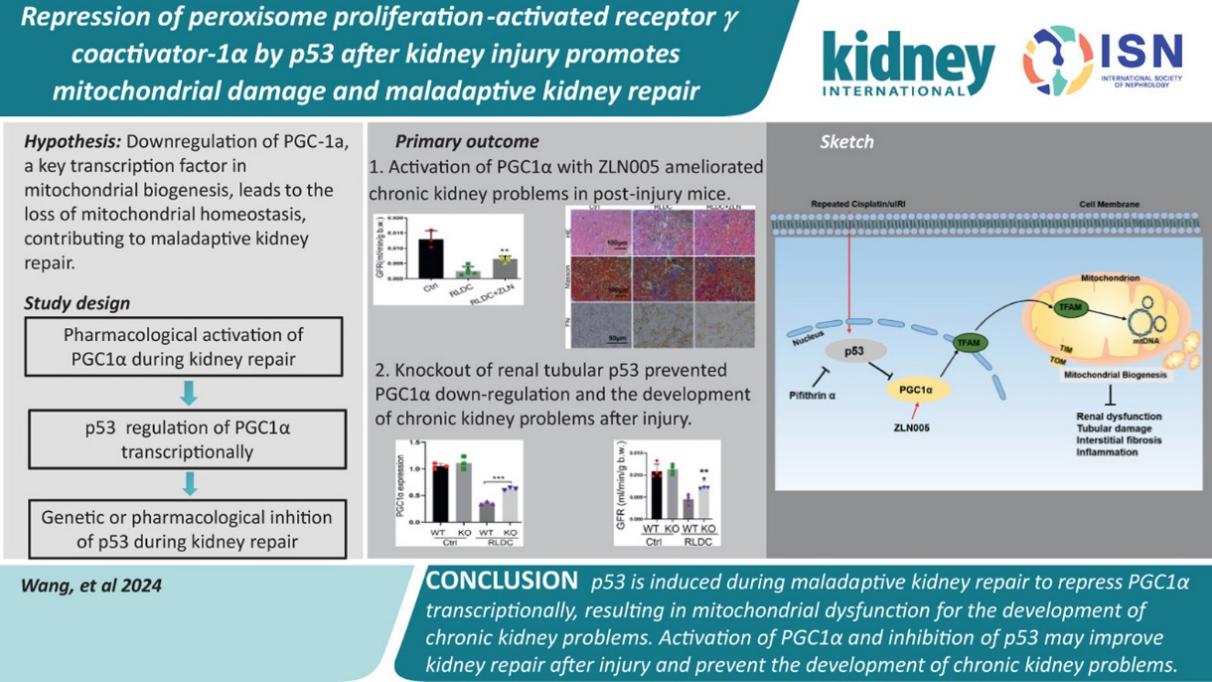
急性肾损伤(acute kidney injury,AKI)是一种以肾功能快速衰退为主要特征的肾脏疾病,通常导致肾小管上皮细胞表型改变,引发促纤维化因子分泌和慢性炎症,促进慢性肾脏疾病(chronic kidney disease, CKD)进展;期间伴随线粒体功能障碍,稳态失衡。PGC-1α是线粒体生物合成的主要上游转录因子,在肾脏近端小管细胞中高度表达,但在AKI和CKD的动物模型以及CKD患者的肾脏组织中,其表达受到抑制。通过药物手段恢复肾脏中的PGC-1α表达可以促进AKI后的肾功能恢复,但PGC-1α在肾脏修复中的调控机制仍不清楚。p53是一种肿瘤抑制因子,通过其转录活性可以调控多种细胞生物学过程。在AKI中,p53在肾近端小管细胞中被诱导,并显著促进AKI的发展。然而,p53在肾脏修复中的具体机制尚不明确。
该研究主要发现PGC-1α在缺血性AKI或顺铂诱导的AKI模型中表达持续下调。在AKI后给予PGC-1α激活剂可以减轻线粒体损伤并改善肾脏功能。AKI后PGC-1α的下调与p53的激活相关,抑制p53可以恢复PGC-1α的表达,减轻线粒体损伤,并缓解CKD的疾病进展。这些结果表明,p53/PGC1α可能是改善AKI损伤后的有效治疗靶点。
原文链接:https://www.kidney-international.org/article/S0085-2538(25)00161-9/abstract
程岩团队揭示GPX4选择性自噬降解新机制
近日,中南大学湘雅二医院药学部程岩教授课题组在国际权威学术期刊《细胞死亡和分化》(Cell Death & Differentiation)(IF:13.7,TOP期刊,中科院一区)在线发表了题为《GPX4-AUTAC促进TRAF6-p62介导的GPX4选择性自噬降解诱导乳腺癌铁死亡》(GPX4-AUTAC induces ferroptosis in breast cancer by promoting the selective autophagic degradation of GPX4 mediated by TRAF6-p62)的研究性论文,该研究揭示TRAF6-p62信号通路介导GPX4选择性自噬降解的分子机制,并设计、合成新型GPX4蛋白降解剂GPX4-AUTAC,证明GPX4-AUTAC诱导乳腺癌铁死亡,增强化疗药物的敏感性。

本研究发现GPX4在乳腺癌中高表达,并且与患者恶性临床病理特征以及不良预后呈正相关。机制研究表明GPX4通过选择性自噬途径降解,自噬受体p62与GPX4相互作用,E3泛素连接酶TRAF6促进GPX4泛素化并负向调控其蛋白稳定性。进一步,设计合成新型GPX4自噬降解剂GPX4-AUTAC,结合定量蛋白质组学质谱分析和机制研究,明确GPX4-AUTAC与GPX4结合并促进其选择性自噬降解。体外实验、体内模型及患者来源类器官模型证明GPX4-AUTAC促进铁死亡并抑制乳腺癌进展。GPX4-AUTAC与化疗药物联合应用具有协同抑制细胞增殖的作用,且无显著毒副作用。研究成果将为乳腺癌精准治疗、化疗增敏提供新的治疗策略,为靶向GPX4的药物研发提供思路。
原文链接:https://www.nature.com/articles/s41418-025-01528-1
梁云生团队发表特应性皮炎研究成果揭示新型免疫调控机制与治疗靶点
近日,中南大学湘雅二医院皮肤科梁云生教授团队接连在国际权威期刊《过敏与临床免疫学杂志》(Journal of Allergy and Clinical Immunology)(IF=11.4,中科院一区TOP)与《过敏与免疫学临床评论》(Clinical Reviews in Allergy & Immunology)(中科院1区,IF=10.2)发表一系列特应性皮炎研究相关学术成果,揭示Dupilumab通过TIM-3/TGF-β1轴调控DCs功能的新机制。
特应性皮炎(AD)是一种与遗传素质有关的慢性炎症性皮肤病,发病机制通常涉及2型免疫炎症的异常激活。研究表明,树突状细胞(DCs)有助于诱导2型炎症,在AD的病理生理过程中发挥关键免疫学作用。大量临床试验已证实生物制剂度普利尤单抗治疗AD的安全性和有效性,但其对DCs及其免疫调节的具体机制尚不清楚。该研究团队在过敏领域顶刊《过敏与临床免疫学杂志》(Journal of Allergy and Clinical Immunology)在线发表研究型论著:“度普利尤通过TIM-3-TGF-β1正反馈轴抑制骨髓树突状细胞功能治疗特应性皮炎(Dupilumab-induced inhibition of myeloid dendritic cells function via TIM-3-TGF-β1 feedback loop in treatment of atopic dermatitis)”,首次揭示度普利尤单抗通过TGF-β1-TIM3正反馈轴诱导DC凋亡治疗AD的全新机制,并发现TGF-β1和Galectin9可以作为AD治疗的新靶点。
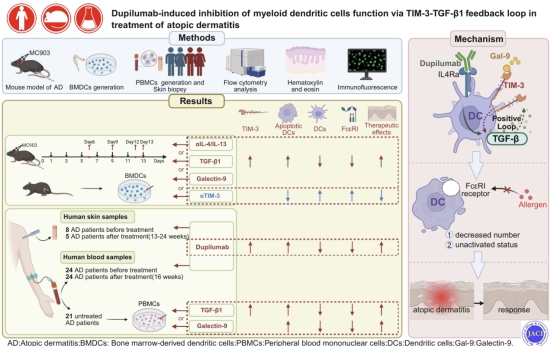
图注:本文的主要方法、结果及机制。本文揭示了Dupilumab通过诱导TIM-3表达抑制髓系DCs功能以改善AD症状,TGF-β1或Gal-9治疗可增强这一作用,表明了靶向TGF-β1/Gal-9-TIM-3轴治疗AD的潜力。
该研究团队通过分析AD患者在度普利尤单抗治疗前后的单细胞测序数据,同时结合空间转录组数据,发现度普利尤单抗显著上调髓系DCs上TIM-3的表达,并确定了度普利尤单抗通过TGF-β1-TIM-3正反馈环对髓系DCs功能进行调节:度普利尤单抗促使DC分泌TGF-β1增加,诱导其表面TIM-3表达;而TIM-3通路正反馈促进更多TGF-β1的分泌,最终导致髓系DCs大量凋亡以及抑制FcεRI的表达,有效缓解了AD的炎症反应。此外,该研究团队通过体内外实验,揭示了Galectin-9和TGF-β1激活TIM-3通路,抑制FcεRI的表达和诱导髓系DCs凋亡抑制AD炎症反应,发现TGF-β1和Galectin-9可以作为AD治疗新靶点。
王春喻团队在《Metabolism-clinical and experimental》发表综述新成果
近日,中南大学湘雅二医院神经内科、医学遗传科王春喻教授、秦利霞助理研究员团队在《Metabolism-clinical and experimental》(代谢-临床及试验,IF:10.8)在线发表题为“Sarcopenia in Parkinson's disease: from pathogenesis to interventions”(帕金森病的肌少症:从发病机制到临床干预)的新综述。帕金森病(Parkinson's disease)和肌少症(Sarcopenia)是两种常见的与年龄相关的疾病综合征,而肌少症在帕金森病患者中尤为常见,每五名帕金森病患者中就有一名患有严重的肌少症。此外,肌少症与帕金森病患者病程进展、生活质量下降、跌倒和骨折等并发症的发生、甚至死亡风险的增加密切相关。尽管两者之间的具体机制尚不完全明确,大量研究表明,骨骼肌中α-突触核蛋白的聚集、运动神经元的丧失、慢性神经炎症、代谢紊乱和肠道菌群失衡等因素是帕金森病患者出现肌少症的可能机制。然而,现有研究主要集中在单独机制的探讨,关于两者交集的研究仍较为匮乏。在这篇综述中,王春喻教授团队探讨了帕金森病与肌少症之间的相互联系,重点关注其潜在的病理生理机制,并总结了帕金森病合并肌少症患者的可能干预措施。


原文链接:https://doi: 10.1016/j.metabol.2025.156272
武明花课题组揭示早发性卵巢功能不全发病新机制
近日,湘雅基础医学院肿瘤研究所武明花课题组在国际著名期刊《Advanced Science》(中科院1区Top期刊,IF 14.3)上在线发表了题为“LRRC4 Deficiency Drives Premature Ovarian Insufficiency by Disrupting Metabolic Homeostasis in Granulosa Cells”(LRRC4缺失通破坏颗粒细胞代谢稳态导致早发性卵巢功能不全)的原创性研究。该研究系统阐释了脑组织相对特异性高表达基因LRRC4(Leucine-Rich Repeat Containing 4)在卵泡发育调控中的关键作用及分子机制,为早发性卵巢功能不全(Premature Ovarian Insufficiency,POI)的诊疗提供了新思路。POI是指女性在40岁之前出现卵巢功能减退的临床综合征,是女性不孕不育的重要原因之一,发病机制不明,早期诊断和治疗策略受限。本研究首次发现LRRC4是卵巢颗粒细胞中调控卵泡发育的关键因子,对维持卵巢储备功能至关重要,其表达缺失可抑制颗粒细胞分化,造成卵母细胞成熟障碍及卵泡过度闭锁,最终导致POI。进一步研究显示:LRRC4通过增强Yes相关蛋白(Yes-Associated Protein, YAP)的K48多聚泛素化降解,调控线粒体分裂/融合的动态平衡,抑制线粒体自噬的过度激活,维持线粒体有氧呼吸与糖酵解的代谢稳态。补充LRRC4可有效改善POI模型小鼠卵泡发育,恢复卵巢功能。本研究揭示了LRRC4缺失介导的POI发病的新机制,为POI的防治提供了新的靶点和理论依据。
文章链接:http://doi.org/10.1002/advs.202417717.
武明花课题组揭示胶质母细胞瘤恶性进展新机制
近日,湘雅基础医学院肿瘤研究所武明花课题组在国际著名期刊Journal of Advanced Research(中科院1区Top期刊,IF 11.4)上在线发表了题为“Targeting mesenchymal monocyte-derived macrophages to enhance the sensitivity of glioblastoma to temozolomide by inhibiting TNF/CELSR2/p65/Kla-HDAC1/EPAS1 axis”(靶向间充质单核细胞来源的巨噬细胞抑制TNF/CELSR2/p65/Kla-HDAC1/EPAS1信号轴增强胶质母细胞瘤对替莫唑胺治疗的敏感性)的原创性研究。该研究鉴定出一群具有间充质样表型的单核细胞来源的巨噬细胞(Mesenchymal Monocyte-derived Macrophages,MES-MDM),并揭示了其促进肿瘤细胞表型转化的新机制,为克服替莫唑胺治疗耐药性提供了新靶点。
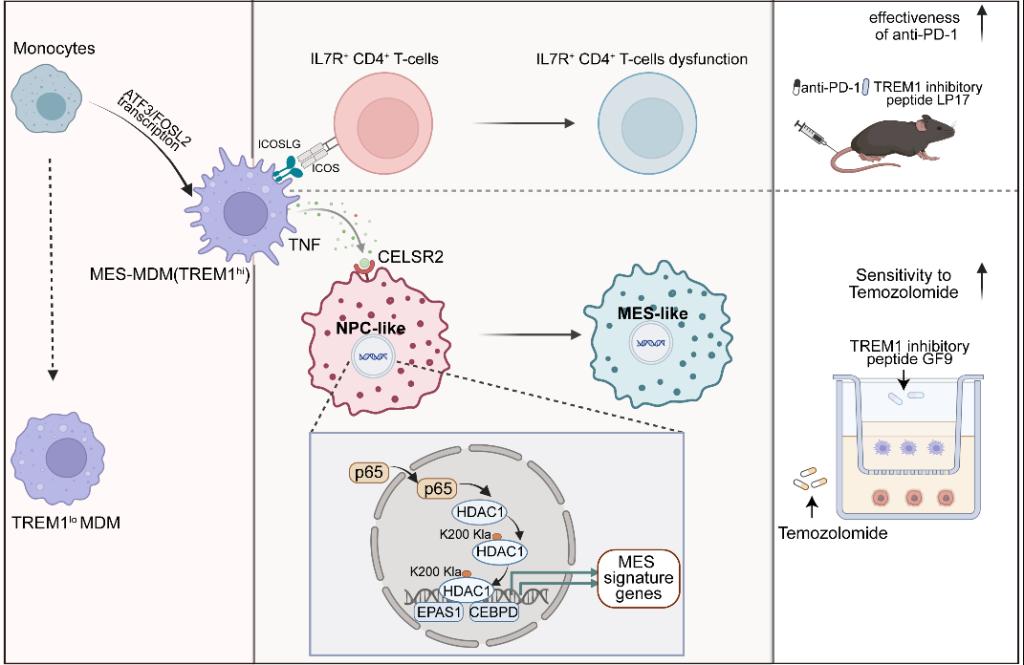
胶质母细胞瘤(glioblastoma, GBM)是成人最常见的颅内恶性肿瘤。尽管患者接受了最大范围的手术切除,并辅以替莫唑胺(Temozolomide,TMZ)、放疗、免疫或电场治疗等综合措施,但患者的复发率和耐药性仍然很高。目前,制约GBM预后的生物学因素主要包括肿瘤的高侵袭性、肿瘤细胞和免疫抑制微环境的异质性等。因此,深入解析GBM细胞与免疫微环境的异质性及相互作用规律,对阐明GBM恶性进展的机制及探寻克服TMZ耐药的治疗靶点至关重要。本研究首次鉴定出了高表达TREM1的新型MES-MDM亚群,该亚群可通过非经典的TNF-CELSR2配受体对介导肿瘤细胞HDAC1的K200位点发生乳酸化修饰,促进肿瘤细胞向MES-GBM细胞恶性转化。TREM1抑制肽靶向MES-MDM可增加GBM对TMZ的敏感性。本研究揭示了MDM新亚群导致GBM恶性进展的新机制,并为增加TMZ治疗敏感性提供了新靶点。
文章链接:http://doi.org/10.1016/j.jare.2025.05.032
王念团队成果在Science子刊发表
近日,国际期刊Science子刊《Science Advances》发布中南大学湘雅基础医学院病理生理学系王念副教授参与的研究成果“A neuroimmune pathway drives bacterial infection (一种神经免疫通路驱动细菌感染)”。
病原体诱导的脓毒症死亡构成了重大的公共卫生挑战,其神经免疫机制尚未被充分阐明。本研究旨在探讨神经递质对ACOD1表达的调控作用。ACOD1是由细菌脂多糖(LPS)激活的免疫代谢调节因子。通过筛选多种神经递质,研究者发现多巴胺在先天免疫细胞中可显著抑制LPS诱导的ACOD1表达。机制上,DRD2可与TLR4形成复合物,进而激活MAPK3依赖的CREB1磷酸化,启动ACOD1转录。相反,多巴胺通过DRD2干扰TLR4与MYD88的相互作用,但并不影响LPS诱导的TLR4-MD2-CD14复合物的形成。ACOD1表达上调可诱导CD274/PD-L1的生成,而这一过程独立于其代谢产物itaconate,从而在脓毒症中加剧炎症相关的免疫抑制。研究者进一步发现,延迟给予多巴胺受体激动剂普拉克索(pramipexole)可显著降低细菌性脓毒症小鼠模型的死亡率;相反,使用多巴胺受体拮抗剂阿立哌唑(aripiprazole)则加剧了脓毒症的致死率。此外,患者体内多巴胺-ACOD1轴的调控失衡与脓毒症严重程度密切相关,提示该神经免疫通路可能为未来脓毒症治疗提供新的靶点。上述发现揭示了神经递质与先天免疫之间的直接联系,并提示通过调控ACOD1信号通路可为致死性感染提供潜在治疗策略。

原文链接:
https://www.science.org/doi/10.1126/sciadv.adr2226?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
开天瀚团队研发智能导电水凝胶,助力糖尿病伤口治疗
2025年5月9日,湘雅公共卫生学院开天瀚教授和丁萍教授团队在国际知名期刊《Advanced Science》(IF=14.3)上发表了题为“An Intelligent and Conductive Hydrogel with Multi-responsive and ROS Scavenging Properties for Infection Prevention and Anti‐Inflammatory Treatment Assisted by Electrical Stimulation for Diabetic Wound”的研究论文。
研究团队创新设计的HEPP智能导电水凝胶,具备pH/活性氧(ROS)/光/电四重响应特性。该材料能实时感知伤口微环境变化,精准释放纳米酶PTPPG,有效分解病灶部位异常积聚的葡萄糖。通过光动力疗法与光热疗法的协同作用,HEPP在杀灭致病菌的同时构建自级联活性氧清除系统,实现持续供氧与病原体抑制的双重保障。
研究证实,HEPP水凝胶通过双重路径重构炎症微环境:其一,清除过量ROS缓解氧化应激;其二,借助电刺激(ES)和凝胶共同靶向干预关键炎症通路实现精准调控。转录组学分析揭示,电刺激通过协同抑制TNF信号通路,显著下调IL-6、TNF-α等促炎因子表达水平。HEPP与ES联合治疗伤口炎症的机制主要体现在对TNF信号通路的联合影响。动物实验数据显示,该疗法使糖尿病模型小鼠的伤口愈合效显著提升。
综上所述,HEPP的成功研发标志着糖尿病伤口管理进入智能响应时代。这种集成微环境响应、按需释药、动态调节,电刺激联合治疗功能的"一体化"治疗平台,有望突破传统敷料的被动治疗局限。研究团队目标是实现精准医疗,为全球糖尿病患者提供更优创面管理方案,推动慢性伤口治疗从症状控制向病理干预的范式转变,为改善患者生存质量带来新曙光。
周文虎团队在《Journal of Controlled Release》杂志发表最新研究成果
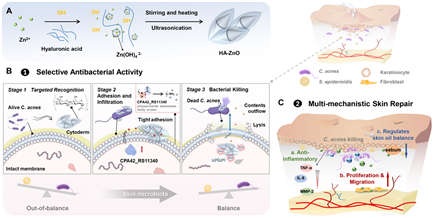
近日,中南大学湘雅药学院周文虎教授团队在国际权威期刊《Journal of Controlled Release》(中科院一区TOP期刊,影响因子10.5)上以Research Article形式发表原创性论文:“Biomimetic hyaluronic acid-stabilized zinc oxide nanoparticles in acne treatment: A preclinical and clinical approach”。上述研究报道了一种基于透明质酸(HA)稳定的纳米氧化锌(HA-ZnO)新型痤疮治疗技术。该技术通过非抗生素途径实现高效抗菌、精准修复与瘢痕预防,为痤疮治疗提供了创新性解决方案,该技术平台基于纳米载体靶向递送系统,可拓展至特应性皮炎、湿疹、伤口感染等皮肤疾病治疗领域。目前已布局3项核心发明专利,形成覆盖纳米制备工艺创新与多适应症扩展的技术壁垒,解决传统纳米制剂靶向性差、功效单一等瓶颈问题。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0168365925003748?via%3Dihub
曾文彬、董界团队在《Bioactive Materials》杂志发表最新研究成果
近日,中南大学湘雅药学院曾文彬教授-董界副教授团队在国际权威期刊《Bioactive Materials》(中科院一区Top期刊,IF = 18.0)上发表了题为“Harnessing advanced computational approaches to design novel antimicrobial peptides against intracellular bacterial infections”的原创性研究论文,为抗胞内菌感染药物开发开辟全新路径。
胞内菌可通过寄生于宿主细胞实现持续性感染,或利用“特洛伊木马”方式劫持巨噬细胞广泛传播实现多部位感染。目前,临床上对于胞内菌感染的治疗方案,主要依靠长期大剂量使用抗生素。然而,常规抗生素药物难以突破宿主细胞的生物膜屏障,不仅治疗效果大打折扣,还会带来严重的药物不良反应。
为了高效开发新型抗胞内菌感染药物,该团队开创性地将计算机辅助药物设计应用于抗胞内菌药物开发,提出整合人工智能预测、分子动力学模拟与实验验证的三位一体开发策略。针对胞内菌感染复杂生理环境,采用多级人工智能预测系统平衡候选药物的活性和毒性。基于跨尺度分子动力学模拟构建肽-膜相互作用综合评价体系,从原子层面解析候选分子的靶向性与作用机制。随后,制定系统的实验方案对于目标分子的生物活性进行全面验证。该研究成功从CPPsite 2.0数据库中筛选出候选药物Crot-1。实验结果表明,Crot-1可以高效清除寄生于巨噬细胞内的金黄色葡萄球菌,同时对宿主细胞保持良好的生物相容性。该研究不仅为抗胞内菌感染药物开发提供了新的途径,更构建了一套可扩展的计算驱动框架。其核心价值在于:宏观性质预测(AI)与微观机制解析(分子模拟)互补,突破传统试错模式;可适配不同靶点与疾病场景,为新型抗菌药物开发提供新的范式。
原文链接:https://doi.org/10.1016/j.bioactmat.2025.04.016
王加充团队发表外泌体前沿综述
近日,中南大学湘雅医学院附属海口医院神经外科王加充教授团队连发两篇外泌体前沿综述,分别登上国际期刊《Molecular Cancer》(IF=27.7)与《Theranostics》(IF=12.4)。其中,《Emerging role of exosomes in cancer therapy: progress and challenges》一文系统梳理外泌体在肿瘤精准治疗中的作用,涵盖其生物发生机制、天然与工程化载药策略、纳米杂合体系设计,以及在肺癌、胃癌、肝癌、胰腺癌等多癌种中实现化疗增敏、免疫调控与基因编辑的最新进展,并深入分析大规模制备、纯化标准化和临床转化面临的瓶颈与对策;而《Exosomes: innovative biomarkers leading the charge in non-invasive cancer diagnostics》则聚焦外泌体作为液体活检“创新生物标志物”的诊断潜力,概述其在血液、尿液、唾液等多体液中反映肿瘤分子异质性的优势,系统盘点呼吸、消化、血液、神经等多系统癌症的候选RNA/蛋白标志物与正在推进的临床试验,并评估超速离心、微流控捕获及AI-辅助检测等技术路线,为外泌体“诊断-监测-预后”一体化应用描绘了清晰蓝图。两篇重磅综述共同展示了该团队在外泌体基础研究与转化医学领域的深厚实力,为肿瘤无创诊断和精准治疗开辟了新路径。

原文链接:https://doi.org/10.1186/s12943-024-02215-4

原文链接:https://www.thno.org/v15p5277.htm




