近日,湘雅科研团队取得了多项突破。敲黑板!一起看看2025年6月的科研成果吧~
以下成果根据湘雅各二级学院、附属医院官网等整理。
● 张春芳团队在《氧化还原生物学》发表肿瘤研究相关成果
● 湘雅医院肾上腺疾病多学科团队为原醛症(PA)精准分型诊治提供新方案
● 周蓉蓉、艾可龙发表放疗与纳米STING激动剂重要研究成果
● 鲁琼、徐冉团队发文揭示免疫靶点设计的未来前景
● 黎志宏团队在骨肉瘤顺铂耐药机制研究中取得重要突破
● 刘傥、梁陆新团队在《Chemical Engineering Journal》杂志发表研究
● 牛诚诚团队发表声动力响应仿生纳米平台协同靶向铁死亡与CD47的原创研究成果
● 龙海团队发表肥大细胞研究领域综述成果
● 施雯团队发表糖尿病视网膜病变协同治疗新策略
● 向大雄、吴军勇团队在肿瘤协同免疫治疗领域取得新进展
● 蔡晶团队发表综述:基于铜死亡协同策略的纳米材料在癌症治疗中的研究进展。
● 刘立宏团队发表神经生长因子纳米新剂型:跨学科突破重塑骨质疏松治疗格局
● 易文君团队提出可将Semi-ALNP模型用于乳腺癌腋窝淋巴结转移风险的精准评估
● 周智广、肖扬团队开发糖尿病精准分型新方法助力临床诊断
● 陈翔宇团队在癌症深部精准治疗领域取得创新性研究成果
● 周建大、吴唯团队发表最新原创性研究成果
● 蔡菁菁团队揭示移植血管三级淋巴器官Tfh细胞来源及其分化机制
● 周文虎团队发表机器学习赋能纳米药物研究综述
● 周文虎团队发表创新性研究成果:智能纳米银实现"精准杀菌-自噬促愈"双效协同治疗
● 邬麟团队发表一项由研究者发起的关于信迪利单抗联合化疗方案一线治疗广泛期小细胞●肺癌(ES-SCLC)的临床研究成果
● 欧阳取长团队发表Trop2ADC药物Sac-TMT对标准治疗耐药的不能手术局部晚期或转移性实体瘤的I/II期临床研究结果
● 罗嘉团队发表靶向药物联合免疫治疗组对比对照组一线治疗不可切除肝细胞癌的III期临床研究成果
● 侯静团队发表基于CT扫描检测和诊断骨转移的一种临床应用的人工智能系统的临床研究成果
张春芳团队在《氧化还原生物学》发表肿瘤研究相关成果
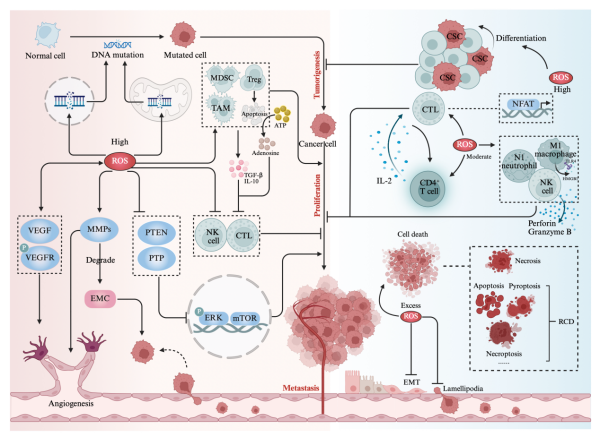
近日,中南大学湘雅医院张春芳教授团队在《Redox Biology》(《氧化还原生物学》)(IF:11.25)上发表题为“Targeting oxidative stress-mediated regulated cell death as a vulnerability in cancer”(《靶向氧化应激介导的肿瘤细胞调节性死亡》)的综述论文。

在癌细胞中,活性氧(ROS)既是“助燃剂”,也是“刽子手”。在可控范围内,ROS可促进肿瘤的发生与发展,而当其超过阈值,又会引发多种类型的调节性细胞死亡(RCD),成为抑制肿瘤的潜在“武器”。文章首先阐述了细胞内ROS动态平衡的调控网络,随后聚焦于肿瘤细胞中特有的氧化还原失衡现象,揭示了ROS在肿瘤生长与抑制之间“亦敌亦友”的复杂关系。此外,文章综述了ROS与多条肿瘤相关信号通路的交叉调控机制,展示了ROS在肿瘤细胞中构建的复杂网络。更为关键的是,文章重点分析了ROS介导的调节性细胞死亡的调控机制,并总结了基于这一机制的癌症治疗策略及潜力药物。文章最后还探讨了ROS及氧化损伤检测的技术难点与发展前景,为今后ROS相关肿瘤治疗策略的临床转化提供了理论基础和研究方向。我们期待,这一综述能为开发新型癌症治疗手段提供有力支持,推动氧化应激相关RCD机制在临床上的进一步应用。
湘雅医院肾上腺疾病多学科团队为原醛症(PA)精准分型诊治提供新方案
中南大学湘雅医院肾上腺疾病多学科诊疗(MDT)团队近日在核医学顶刊《Clinical Nuclear Medicine(临床核医学杂志)》(Q1, IF=10.6)发表突破性研究"First-in-Human Evaluation of [18F]AldoView: A Highly Selective PET Tracer for Aldosterone Synthase Imaging in Primary Aldosteronism(高选择性醛固酮合成酶PET示踪剂[18F]AldoView在原发性醛固酮增多症患者中的首次人体评估研究)",成功完成世界首个靶向醛固酮合成酶(CYP11B2)的高度选择性示踪剂[18F]AldoView的人体PET/CT显像研究,为解决原发性醛固酮增多症(原醛症,PA)的精准分型诊治提供创新方案。

该研究显示,[18F]AldoView具有优异的成像性能和良好的辐射剂量学特性,未见明显不良反应。同时,[18F]AldoView PET/CT在鉴别肾上腺病灶(包括直径>10mm的典型腺瘤和小至5mm的微小结节等)中均展现出显著优势—其通过特异性靶向CYP11B2,可以无创地对人体内肾上腺中CYP11B2的表达进行可视化,实现基于核医学分子影像的“透明病理”,实现对醛固酮分泌结节、无功能腺瘤与皮质醇分泌腺瘤的代谢表型区分(图1,2)。该技术突破了传统AVS操作的局限性及68Ga-Pentixafor PET/CT显像对微小结节及混合型腺瘤的鉴别瓶颈,为肾上腺皮质腺瘤的精准分型及个体化治疗决策提供了关键依据。
周蓉蓉、艾可龙发表放疗与纳米STING激动剂重要研究成果
近日,中南大学湘雅医院肿瘤科周蓉蓉教授团队、中南大学湘雅药学院艾可龙教授团队围绕放疗与STING激动剂的协同抗肿瘤作用,在《Molecular Cancer(分子癌症)》(IF=33.9,中科院1区TOP期刊)发表题为“Enhancing radiotherapy-induced anti-tumor immunity via nanoparticle-mediated STING agonist synergy”(纳米STING激动剂协同放疗增强抗肿瘤免疫)的重要综述。

放射治疗是肿瘤治疗手段之一,可诱导免疫原性死亡并激活cGAS-STING途径而调控肿瘤微环境。然而,cGAS-STING通路的短暂激活一定程度限制了抗肿瘤免疫。因此,联合应用STING激动剂或许有助于增强放疗的抗肿瘤免疫。同时,纳米药物可靶向递送STING激动剂可克服传统STING激动剂具有脱靶毒性、细胞膜渗透性差和生物利用度低等缺点。基于此,周蓉蓉教授、艾可龙教授团队充分探讨放疗联合纳米STING激动剂调控抗肿瘤免疫的作用及机制,为后续研究提供重要的理论总结。
原文链接:
https://link.springer.com/article/10.1186/s12943-025-02366-y?utm_source=rct_congratemailt&utm_medium=email&utm_campaign=oa_20250611&utm_content=10.1186/s12943-025-02366-y
鲁琼、徐冉团队发文揭示免疫靶点设计的未来前景
近日,中南大学湘雅二医院药学部鲁琼教授和泌尿外科徐冉教授课题组在Journal of Hematology & Oncology杂志(中科院一区TOP,影响因子40.4)在线发表了题为“Insights into next-generation immunotherapy designs and tools: molecular mechanisms and therapeutic prospects”的论文。

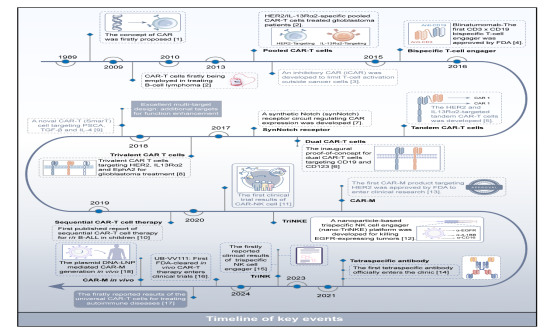
免疫疗法已彻底改变肿瘤治疗范式,其中CAR-T细胞疗法尤其成为治疗血液系统恶性肿瘤的重要里程碑。然而,由于靶点异质性或突变导致的肿瘤耐药性仍是免疫治疗领域的难题。本综述系统阐释了新一代免疫治疗工具(涵盖基因工程免疫细胞、多特异性抗体及细胞衔接器)的分子机制与治疗潜力,着重探讨了通过多靶向策略提升个体化免疫疗效的路径。基于逻辑门调控回路、适配体介导的CAR、多特异性抗体和细胞衔接器等技术的开发,可在识别肿瘤信号的同时最大限度降低毒副作用。最后,本文还重点分析了促进定制化免疫治疗的基因递送、基因编辑等关键技术,并探讨了人工智能在基因编辑免疫细胞领域的广阔前景。
黎志宏团队在骨肉瘤顺铂耐药机制研究中取得重要突破
近日,中南大学湘雅二医院黎志宏团队在《ADVANCED SCIENCE》(IF:13.7)发表了题为“A Dual Approach with Organoid and CRISPR Screening Reveals ERCC6 as a Determinant of Cisplatin Resistance in Osteosarcoma”的原创性论文,揭示了骨肉瘤顺铂耐药机制及潜在治疗靶点。研究通过构建三维骨肉瘤类器官模型,成功模拟了患者体内的耐药演化过程,并揭示了关键耐药分子ERCC6的作用机制,为解决临床化疗耐药问题提供了新的思路和潜在靶点。
团队从骨肉瘤患者术中新鲜组织中成功建立高保真度的三维类器官体系。经免疫组化和单细胞测序验证,该类器官在组织结构与分子特征方面高度还原原发肿瘤。本研究首次提出高成功率、标准化的骨肉瘤类器官建立流程,为该疾病的体外研究提供了可靠模型基础。
在此基础上,研究团队通过顺铂持续刺激构建获得性耐药类器官模型,并联合CRISPR-Cas9全基因组筛选技术,识别出DNA修复相关蛋白ERCC6为骨肉瘤顺铂耐药的关键调控因子。进一步功能研究发现,沉默ERCC6能够显著增强骨肉瘤细胞对顺铂的敏感性并诱导凋亡。
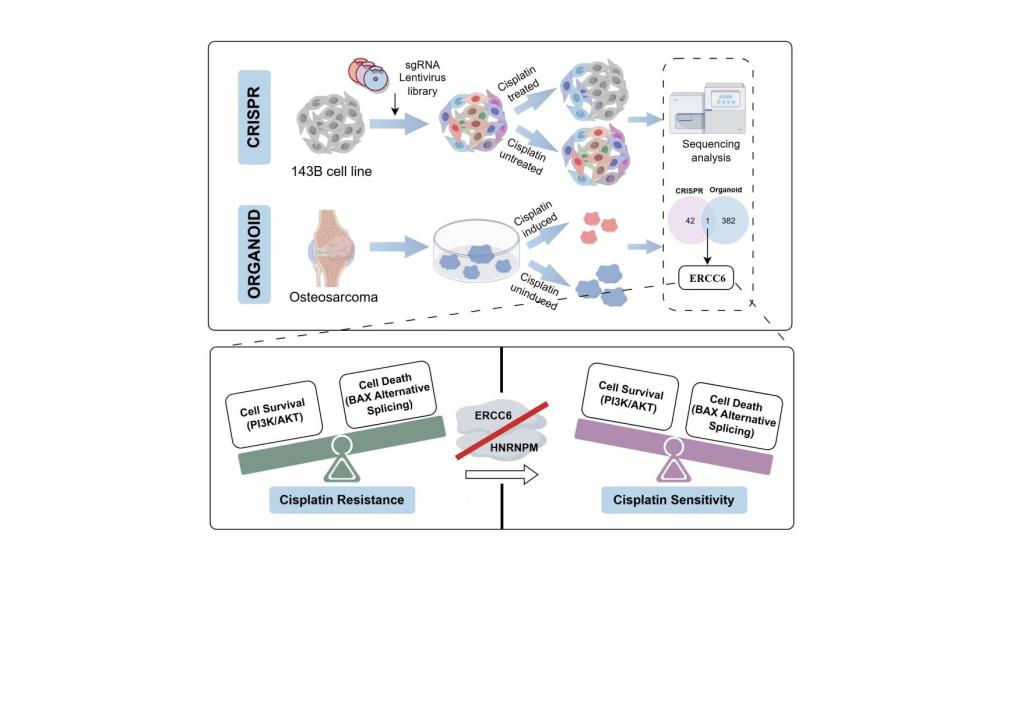
机制层面,研究发现ERCC6可通过与RNA结合蛋白HNRNPM相互作用,激活PI3K/AKT信号通路,并调控BAX基因的可变剪接,从而抑制细胞凋亡、促进耐药形成。
本研究首次在类器官水平建立骨肉瘤耐药演化模型,阐明了ERCC6介导的耐药通路,为骨肉瘤个体化治疗及逆转化疗耐药提供了重要的实验依据和新型治疗靶点。
刘傥、梁陆新团队在《Chemical Engineering Journal》杂志发表研究
近日,中南大学湘雅二医院刘傥教授、梁陆新助理研究员团队在《Chemical Engineering Journal》(JCR Q1;中科院一区,IF=13.2)发表论著“Improved degradable, mechanical, and osteoimmunity-regulating performances of additively manufactured Zn-Mg alloy with heterogeneous microstructure for augmented bone regeneration”。本研究通过激光增材制造技术(3D打印)制备了具有异质结构的可吸收医用Zn-Mg合金,探究了激光能量密度对锌合金材料微观组织,力学和降解性能的影响。研究发现“双峰”异质微观结构提升了合金的力学强度和降解速率,同时,锌镁合金降解产物通过抑制HIF-1α/NF-κB和JAK-STAT信号通路调控巨噬细胞从促炎M1型向抗炎M2型极化,从而改善骨免疫微环境,促进成骨和血管生成,并抑制破骨细胞活性。总之,该研究阐明了“双峰”异质微观结构对合金的降解-促成骨耦合机制,为3D打印可降解Zn基合金骨科器械的应用与转化提供了理论和技术支持。

原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S1385894725047321
牛诚诚团队发表声动力响应仿生纳米平台协同靶向铁死亡与CD47的原创研究成果
近日,中南大学湘雅二医院超声科牛诚诚教授团队在国际期刊《Journal of Nanobiotechnology》(中科院一区,影响因子12.1)发表题为 “Sonodynamic therapy�boosted biomimetic nanoplatform targets ferroptosis and CD47 as vulnerabilities for cancer immunotherapy” 的原创研究论文。
该研究团队构建了一种创新性的声动力响应仿生纳米平台(IMP@CM-PEP20),通过联合诱导铁死亡与阻断免疫检查点CD47,有效激活抗肿瘤免疫应答,显著改善免疫抑制性“冷”肿瘤微环境。
尽管肿瘤免疫治疗取得显著进展,但其疗效常受免疫抑制性“冷”肿瘤微环境(TME)限制。诱导免疫原性细胞死亡(ICD)被认为是改善TME、激活免疫反应的有效手段。铁死亡作为一种依赖铁的脂质过氧化型ICD,在难治性和耐药性肿瘤中表现出良好的治疗潜力。CD47则作为肿瘤细胞的“免疫逃逸信号”,通过抑制巨噬细胞功能实现免疫逃逸。铁死亡诱导联合CD47阻断,有望实现肿瘤清除与免疫激活的协同治疗效果。
纳米平台采用4T1细胞膜作为靶向外壳,并偶联CD47抑制肽PEP20,实现精准递送。MnO₂与IR780协同作用,在超声激发下引发谷胱甘肽耗竭,诱导铁死亡并促进ICD,激发强效的T细胞免疫反应;同时PEP20阻断CD47–SIRPα信号轴,促进M2向M1表型转化,增强巨噬细胞吞噬功能。
在4T1乳腺癌小鼠模型中,该纳米平台显著抑制肿瘤生长、有效预防复发,并诱导系统性、持久性的抗肿瘤免疫反应,验证了该策略的可行性与广阔应用潜力。
该研究揭示了“铁死亡+CD47阻断”的协同免疫治疗策略在重塑肿瘤微环境、激活免疫系统中的重要作用,为克服免疫治疗耐药和TME限制提供了新的解决方案,也为相关纳米免疫疗法的临床转化奠定了坚实基础。

原文链接:https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-025-03485-w
龙海团队发表肥大细胞研究领域综述成果
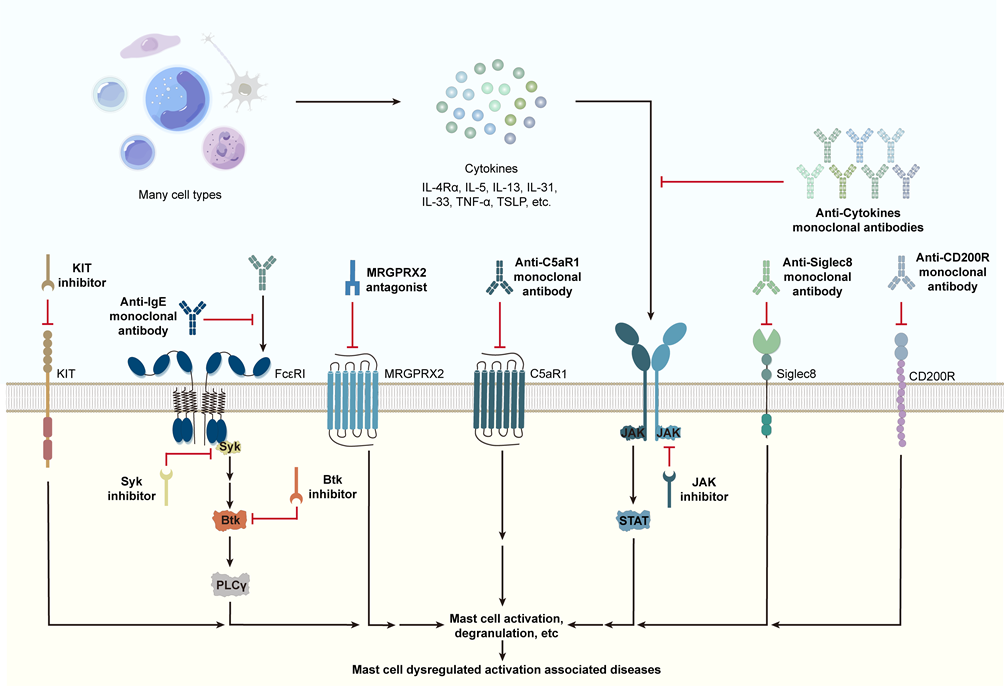
近日,中南大学湘雅二医院皮肤科、医学表观遗传组学湖南省重点实验室龙海教授团队在《过敏与免疫学临床评论》(Clinical Reviews in Allergy & Immunology)(中科院1区,IF=11.3)在线发表题为“Aberrant Activation of Mast Cells: Molecular Mechanisms and Targets for Intervention”(肥大细胞的异常激活:分子机制到治疗靶点)的新综述。

肥大细胞通过介导宿主防御和维持组织平衡在先天免疫中起着关键作用。其功能受到内环境中复杂的细胞与分子网络的精密调控。过敏原暴露或内在因素引起的肥大细胞异常激活或调节障碍会导致包括过敏性疾病与自身免疫性疾病在内的多种疾病。目前抗肥大细胞疗法已从广谱抗组胺药扩展到更精确的针对其表面与内部受体的靶向治疗。在这篇综述中,龙海教授团队探讨了肥大细胞异常活化的分子机制网络,并总结了现有与可能的靶向肥大细胞激活的干预措施。通过解析肥大细胞信号网络并联系相关疾病发生机制,为寻找新的治疗靶点提供帮助。
施雯团队发表糖尿病视网膜病变协同治疗新策略
近日,中南大学湘雅二医院眼科施雯团队在国际权威期刊《Materials Today Bio》(中科院一区,IF=10.2)发表题为《Thermosensitive hydrogel composite with si-Cx43 nanoparticles and anti-VEGF agent for synergistic treatment of diabetic retinopathy》的研究论文。该研究创新性地开发了一种负载si-Cx43纳米颗粒与抗VEGF药物的温敏水凝胶复合系统,为糖尿病视网膜病变(DR)的治疗提供了可能的突破性解决方案。

该研究创新性地将靶向连接蛋白Cx43的siRNA纳米颗粒(si-Cx43-NPs)与抗VEGF药物-贝伐珠单抗(Avastin)封装于温敏透明质酸水凝胶中,形成具有温度响应特性的药物递送系统。实验证实,该系统能同步抑制病理性血管生成和炎症反应,显著改善高糖环境下视网膜内皮细胞功能,并在动物模型中实现视网膜结构修复与功能恢复。这一成果可能突破现有抗VEGF疗法需频繁注射的临床瓶颈,为DR治疗提供了多靶点协同干预的新模式。
论文链接:https://doi.org/10.1016/j.mtbio.2025.101917
向大雄、吴军勇团队在肿瘤协同免疫治疗领域取得新进展
近日,中南大学湘雅二医院药学部、湖南省转化医学与创新药物工程技术研究中心向大雄教授与吴军勇副研究员团队在肿瘤协同免疫治疗领域取得新进展。研究成果以《Biomimetic self-assembly nanoparticles inhibit serpinB9 and synergistically enhance COD-induced ferroptosis for cancer therapy》为题,在国际学术期刊《Materials Today Bio》上发表。

免疫细胞分泌的颗粒酶B(GrB)在通过诱导细胞凋亡来对抗肿瘤中起着关键作用。然而,肿瘤细胞常常通过高表达丝氨酸蛋白酶抑制剂SerpinB9(Sb9)来抑制GrB的功能,从而实现免疫逃逸。此外,肿瘤微环境中积累的胆固醇不仅会抑制肿瘤细胞“铁死亡”,还会损害免疫细胞功能,进一步阻碍GrB的分泌。因此,开发能够同时抑制Sb9并克服胆固醇介导的耐药性的新策略对于癌症治疗至关重要。
为了应对这些挑战,该团队设计并构建了一种多功能的仿生自组装纳米药物递送系统(简称CPM)。该系统通过金属-酚类网络自组装技术,将Sb9的小分子抑制剂——原儿茶酸(PCA)和能够催化胆固醇氧化以降解胆固醇的胆固醇氧化酶(COD)共同包载,并在表面包裹巨噬细胞膜,以增强纳米粒在体内的稳定性和肿瘤靶向性。CPM纳米粒靶向肿瘤后,其装载的PCA能够有效抑制Sb9的表达,从而增强GrB诱导的细胞凋亡。与此同时,COD通过降解肿瘤微环境中的胆固醇,一方面下调谷胱甘肽过氧化物酶4(GPX4)和铁死亡抑制蛋白1(FSP1)的表达来诱导铁死亡;另一方面,有效逆转了由高胆固醇引发的免疫抑制,激活了抗肿瘤免疫应答,为肿瘤治疗提供了一种安全有效的新策略。
原文链接:https://www.sciencedirect.com/science/article/pii/S2590006425005526
蔡晶团队发表综述:基于铜死亡协同策略的纳米材料在癌症治疗中的研究进展
近日,中南大学湘雅二医院病理科蔡晶团队在国际生物材料期刊《Materials Today Bio》(IF=10.2,中科院1区TOP期刊)上发表重要综述论文《Cuproptosis-driven nanostrategies: Synergistic nanoplatforms for tumor microenvironment reprogramming and enhanced anticancer efficacy》。该研究系统构建了“铜死亡-纳米材料”协同理论框架,为克服恶性肿瘤耐药性及重塑免疫抑制微环境提供了创新策略。

研究创新性地提出并阐述了三大协同机制:解析铜死亡与其他死亡模态(如凋亡、铁死亡、焦亡)的级联效应;阐明放疗、声动力治疗、免疫治疗等疗法如何通过调节氧化应激增强肿瘤细胞对铜死亡的敏感性;系统归纳了基于pH、ROS、超声响应等原理设计纳米载体,实现肿瘤特异性铜离子过载的策略。该综述全面梳理了该领域前沿的铜死亡纳米平台,着重分析了其在降低系统毒性、强化靶向递送效能以及重塑抗肿瘤免疫微环境方面的最新进展。同时,前瞻性地探讨了未来研究方向,包括:深入解析FDX1蛋白介导的铜死亡耐药机制、开发可生物降解铜基载体(如铜-硅酸盐纳米粒)、以及构建个体化纳米治疗模型。
原文链接:https://www.sciencedirect.com/science/article/pii/S2590006425004545?via%3Dihub
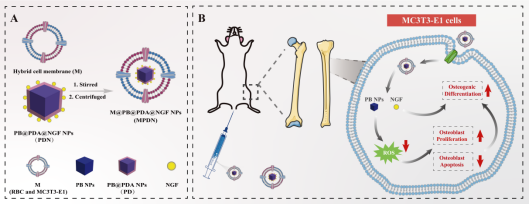
刘立宏团队发表神经生长因子纳米新剂型:跨学科突破重塑骨质疏松治疗格局
近日,中南大学湘雅二医院康复医学科刘立宏团队在国际著名期刊《Materials Today Bio》(中科院1区,IF 10.2)上发表了题为《Nerve growth factor-loaded biomimetic prussian blue nanocomplexes for reversing osteoporosis via promoting osteoblast precursor cell proliferation
and differentiation》(负载神经生长因子的仿生普鲁士蓝纳米复合物通过促进成骨细胞前体细胞增殖和成骨分化来逆转骨质疏松症)的原创性研究。
传统骨质疏松症治疗多聚焦于抑制破骨细胞活性,却无法解决成骨细胞功能受损的核心问题。研究团队从神经损伤患者常并发骨质疏松、骨折愈合延迟等临床现象切入,结合神经-骨骼系统交互作用的前沿理论,首次证实神经生长因子(NGF)在骨质疏松症中的关键作用。但作为大分子蛋白,NGF的体内半衰期短、生物利用度低,其临床应用受到限制。为此,研究团队通过纳米技术实现NGF的剂型改良,成功开发出负载NGF的仿生普鲁士蓝纳米药物(MPDN),为骨质疏松症治疗开辟新路径。
实验结果显示,MPDN纳米药物粒径均一、稳定性良好,可有效逃避免疫系统清除,高效富集于骨骼部位。该纳米药物通过清除活性氧,显著促进成骨前体细胞增殖与成骨分化,在老年性骨质疏松小鼠模型中成功逆转骨丢失。这一创新不仅解决了NGF的递送难题,更从根源上修复了氧化应激导致的成骨功能障碍。
该成果首次明确了NGF在骨代谢中的关键作用,为骨质疏松症治疗提供了新思路和方法,同时为多学科交叉融合创新树立了良好典范。

易文君团队提出可将Semi-ALNP模型用于乳腺癌腋窝淋巴结转移风险的精准评估
近日,中南大学湘雅二医院乳腺外科、乳腺疾病临床医学研究中心易文君教授团队在《电子临床医学》(eClinicalMedicine)(IF:10)上发表题为“通过Semi-ALNP评估乳腺癌患者腋窝淋巴结转移风险:一项多中心研究”(Evaluating axillary lymph node metastasis risks in breast cancer patients via Semi-ALNP: a multicenter study)的原创性研究论文。

腋窝淋巴结是乳腺癌最常见的转移部位,其转移状态直接影响患者的临床分期、治疗方案选择及预后生存。然而,目前临床对腋窝淋巴结的评估尚缺乏足够的分期准确性,导致临床上仍依赖穿刺活检和/或腋窝手术等侵入性方法,亟需一种更为精准、无创且智能化的评估手段。
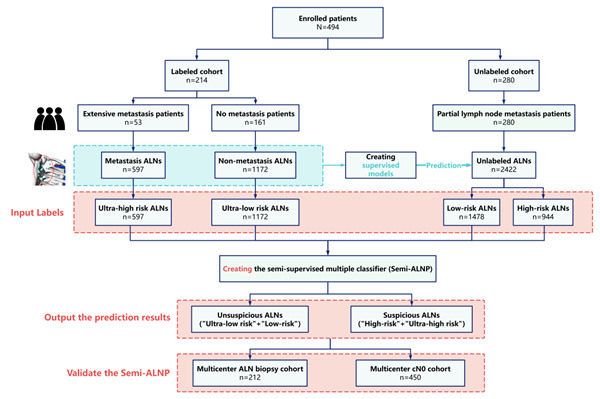
中南大学湘雅二医院易文君教授团队长期致力于乳腺癌腋窝淋巴结人工智能识别与预测模型的研究。在前期研究中,该团队已构建一个基于CT放射组学特征的无监督学习模型,初步实现了对乳腺癌患者腋窝淋巴结转移的预测。为进一步提升模型的分类性能及临床适用性,本研究在此基础上提出并构建了一种结合有标签与无标签数据的半监督多分类模型Semi-ALNP,实现了对腋窝淋巴结转移风险的精准分级。
该研究回顾性纳入了2016年至2024年期间在中南大学湘雅二医院接受治疗的494例乳腺癌患者,共计获取4191枚腋窝淋巴结影像数据。首先,基于214例患者中经标注的1769枚淋巴结构建有监督学习模型,并通过多层感知机(MLP)算法生成伪标签,进一步联合280例患者中未经标注的2422枚淋巴结数据,建立四分类半监督模型Semi-ALNP(将淋巴结风险分为超低、低、高和超高四个等级)。模型在总体队列中表现出优异性能,对于超低、低、高及超高风险的AUC值分别达到0.906、0.936、0.948和0.955,其分类准确性与泛化能力显著优于传统模型。
为进一步验证该模型在真实临床环境中的适用性,本研究联合郴州市第一人民医院、常德市第一人民医院及湘潭市第一人民医院进行了多中心外部验证。在212例临床评估为淋巴结阳性(cN+)并接受穿刺活检的患者中,模型的假阴性率为1.21%,敏感性达98.79%;在450例临床评估为cN0的患者中,模型假阴性率为8.33%,特异性和敏感性均超过90%。验证结果表明,Semi-ALNP模型具有稳定且准确的评估性能,具备良好的临床应用前景。
本研究首次将半监督学习策略应用于乳腺癌腋窝淋巴结多等级风险识别,突破了传统仅限于二分类评估的局限,实现了对腋窝淋巴结状态的精准量化分级评估,为临床个体化手术及治疗方案的制定提供了重要决策支持。未来,研究团队将进一步基于该模型开展大规模前瞻性研究,推动其在真实世界临床场景中的转化与应用。
周智广、肖扬团队开发糖尿病精准分型新方法助力临床诊断
近日,中南大学湘雅二医院代谢内分泌科周智广教授、肖扬教授团队联合香港中文大学马青云教授、英国埃克塞特大学Richard Oram教授,在欧洲糖尿病学会会刊《Diabetologia》(IF:10)在线发表原创性研究论文,首次构建适用于中国人群的1型糖尿病遗传风险评分模型(C�GRS),为糖尿病的精准分型诊断提供了全新工具。
糖尿病是一种血糖升高的慢性代谢性疾病,主要包括1型和2型两种类型。1型糖尿病由免疫系统攻击胰岛β细胞引发,患者需终身依赖胰岛素治疗;而2型糖尿病则多与胰岛素抵抗或分泌不足有关,治疗方式更为多样。当前,糖尿病已成为我国面临的重要公共健康挑战,其中准确分型对于治疗决策和长期管理至关重要。然而,在中国,近三分之二的1型糖尿病患者为成人发病,临床表现常不典型,容易被误诊为2型糖尿病。研究表明,约四分之一新发1型糖尿病患者不携带胰岛自身抗体,进一步加大了临床诊断的难度使诊断难度进一步加大,探索新的糖尿病分型诊断标志物迫在眉睫。
基于此背景,湘雅二医院牵头联合国际团队,针对中国人群糖尿病患者基因特点,对超过2000例中国1型糖尿病患者、1000例2型患者及3000例对照样本进行全基因组关联分析,识别出多个具有中国人群特色的风险遗传位点,构建中国特异性的评分系统,研发了适用于中国人群的1型糖尿病遗传风险评分模型——C‑GRS。目前,该模型已在香港中文大学2万余例糖尿病患者中完成验证,结果显示在中国人群中区分1型与2型糖尿病的准确率明显优于欧美模型,有望显著提升临床诊断的精准性。研究团队后续还将在全国80余家三甲医院招募3000名新诊断患者,开展多中心临床研究,进一步评估其在临床实践中的应用价值。
未来,研究团队计划将该工具与环境因素变量相结合,构建效能更完美的综合预测分型模型,有望用于识别可能发展为1型糖尿病的高风险人群并预测其风险程度,为我国糖尿病精准诊疗体系建设提供有力支撑。
论文链接:https://doi.org/10.1007/s00125-025-06455-x
陈翔宇团队在癌症深部精准治疗领域取得创新性研究成果
近日,中南大学湘雅二医院陈翔宇主任医师团队以题为《一种新型癌症放射光动力治疗方式:伽玛刀联合铜半胱胺纳米颗粒介导的光动力疗法对肝癌的协同治疗研究》(A novel modality of radiation photodynamic therapy for cancer: the combination therapy of gamma knife and Cu-Cy nanoparticle mediated photodynamic effect on liver cancer)于国际知名学术期刊《今日材料物理》(Materials Today Physics)(IF=10)发表了研究成果,为深部肿瘤治疗提供了一种可行的新机制。

本研究团队创造性地提出将伽玛刀发出的高能射线引入PDT体系的假设,作为激发源直接作用于铜半胱胺(Cu-Cy)纳米光敏剂,构建出一种全新的“放射-光动力协同治疗”策略。这种组合不仅保留了伽玛刀精准聚焦、深部穿透的优势,还赋予其免疫调节与细胞级别杀伤的新机制,突破了传统伽玛刀以物理损伤为主的治疗模式。所使用的光敏剂Cu-Cy是一种基于铜离子的纳米材料,具有良好的生物相容性与射线响应能力,可在不依赖能量转换器的前提下直接响应伽玛射线产生活性氧。其在肿瘤常见的弱酸性、高氧化环境中反应更为活跃,具备优良的“肿瘤识别”能力,是实现深部光动力治疗的理想候选材料。
研究团队采用比色反应与荧光探针双重手段,首次实验证实Cu-Cy在伽马射线作用下可发生剂量依赖性的ROS生成反应,揭示了该模式在物理机制层面的可行性。在细胞水平,该组合策略显著抑制多种肝癌细胞增殖与迁移,且对正常肝细胞影响极低,显示出优异的靶向性与生物相容性。进一步动物实验证明,联合治疗可显著抑制肿瘤生长,诱导细胞坏死,且在小鼠全身无明显毒性负担,展现出极强的临床转化潜力。另外,该治疗模式在肿瘤微环境响应方面亦展现出独特优势:在弱酸性环境下ROS生成效率进一步增强,提示其具备“肿瘤特异性激活”机制,有望克服传统疗法对肿瘤异质性的适配障碍。
本研究在不改变现有放疗系统框架与光敏剂材料结构的基础上,通过激发方式的原创性重构,实现了对传统PDT治疗深度与靶向性的双重突破,代表着深部肿瘤精准治疗路径的一次“范式转变”。其“可穿透、可聚焦、可激发”的特征,使其兼具高度创新性、临床可及性与工程可实施性,在肝癌等深部实体瘤治疗中展现出“一体两效”的协同治疗潜力。此次研究的成功,标志着团队在高能射线激发光动力治疗领域实现了从“理论构想”到“实践证明”的关键跨越,也为未来深部肿瘤治疗提供了具有原创性、可推广性的技术方案。
周建大、吴唯团队发表最新原创性研究成果
近日,中南大学湘雅三医院、芙蓉实验室周建大教授课题组和乳甲外科吴唯教授团队合作,在中科院1区TOP期刊《先进研究》(Journal of Advanced Research,IF = 13.0)在线发表了题为“Stattic engineering M2 macrophage-derived exosomes mediate autophagy and immune reprogramming for secondary hyperparathyroidism(负载Stattic的M2外泌体促进自噬与免疫重编程治疗SHPT)”的最新原创性研究成果。

该研究首次提出通过构建负载Stattic的工程化M2外泌体,抑制STAT3通路促进自噬与诱导巨噬细胞M2极化,既能有效减轻甲状旁腺炎症,又能有效抑制甲状旁腺病理性增生,为SHPT提供了创新的潜在方法。动物实验与类器官实验结果证明了M2-E@St是治疗SHPT的绝佳候选药物。周建大与吴唯教授团队长期聚焦SHPT的病理机制与生物工程化治疗研究,先后在甲状旁腺类器官构建与仿生水凝胶支架开发等领域取得多项标志性进展,为本研究奠定了坚实的前期基础。
蔡菁菁团队揭示移植血管三级淋巴器官Tfh细胞来源及其分化机制
近日,中南大学湘雅三医院心血管内科研究员、湖南省心血管疾病研究中心主任蔡菁菁教授团队联合浙江大学徐清波教授团队在心血管顶刊Circulation(循环,IF=38.6)上发表题为“Mitochondrial 1-Carbon Metabolism Drives CD34 Lineage Cells to Differentiate into Tfh Cells to Form Tertiary Lymphoid Organ in Transplant Arteriosclerosis(线粒体一碳代谢驱动CD34谱系细胞分化为Tfh细胞促进移植血管重构中三级淋巴器官形成)”的原创性研究论文。

移植血管重构是导致同种异体器官移植终末期失功的主要原因,阐明移植血管重构的发生机制对于临床防治器官移植失功具有重要意义。研究表明,移植血管外膜中形成的三级淋巴器官是介导移植物免疫排斥及血管重构的关键环节。其中,T滤泡辅助(Tfh)细胞驱动了生发中心及三级淋巴器官的形成,但其来源及分化机制尚未阐明。该研究表明移植血管处Tfh细胞主要源于胸腺CD34谱系细胞,并经淋巴网络转运至移植血管外膜;线粒体一碳代谢途径介导了胸腺来源CD34谱系CD4T细胞向Tfh细胞的分化;靶向一碳代谢关键酶-亚甲基四氢叶酸脱氢酶2(MTHFD2)可用于预防移植血管三级淋巴器官形成及血管重构,为未来移植血管重构的机制研究与药物研发提供了新思路。
原文链接:https://doi.org/10.1161/CIRCULATIONAHA.125.07369
周文虎团队发表机器学习赋能纳米药物研究综述
近日,中南大学湘雅药学院周文虎教授团队在国际权威期刊《Acta Pharmaceutica Sinica B》(中科院一区TOP期刊,影响因子14.7)发表题为《Machine learning reshapes the paradigm of nanomedicine research》的综述论文。该研究系统阐述了机器学习技术在纳米药物研发全流程中的应用,为纳米药物递送系统与人工智能的交叉研究提供了系统性指导。
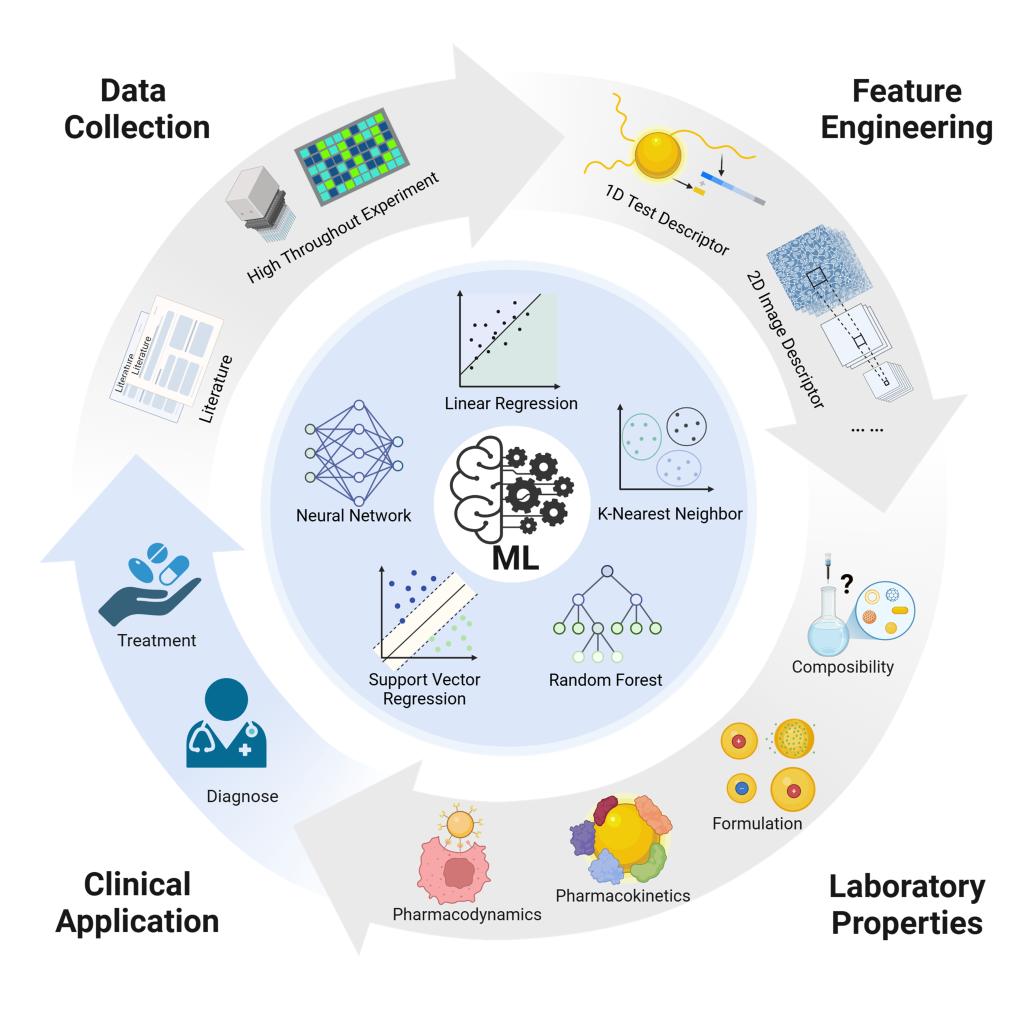
该综述全面梳理了机器学习驱动的纳米药物研究最新进展,涵盖制剂制备、药代动力学、药效学、毒理学及临床转化等关键环节。研究团队详细总结了适用于药学与AI研究者的标准化数据集及表征方法,包括纳米制剂的成分信息(如药物/辅料比例)、物理化学性质(如粒径、Zeta电位)和工艺参数(如搅拌速率、温度),为机器学习在纳米药物研发中的应用奠定了数据基础。此外,研究还整合了细胞水平(如摄取效率)、器官水平(如靶向分布)及动物水平(如血药浓度、肿瘤抑制率)的多尺度数据,构建了更全面的预测模型框架。
原文链接:https://doi.org/10.1016/j.apsb.2025.05.014
周文虎团队发表创新性研究成果:智能纳米银实现"精准杀菌-自噬促愈"双效协同治疗
近日,中南大学湘雅药学院周文虎教授团队在国际权威期刊《Advanced Functional Materials》(中科院一区TOP期刊,NI指数杂志,影响因子19)上发表题为“Smart Nanosilver Strikes Twice: Precision Bacteria Killing Meets Autophagy-Boosted Healing for Infected Wounds”的研究论文。该研究提出了一种创新性pH响应核壳结构纳米银平台(PST/Ag),实现了感染性伤口的“精准杀菌-自噬促愈”双效协同治疗,开创了纳米银在组织修复领域的新应用模式。
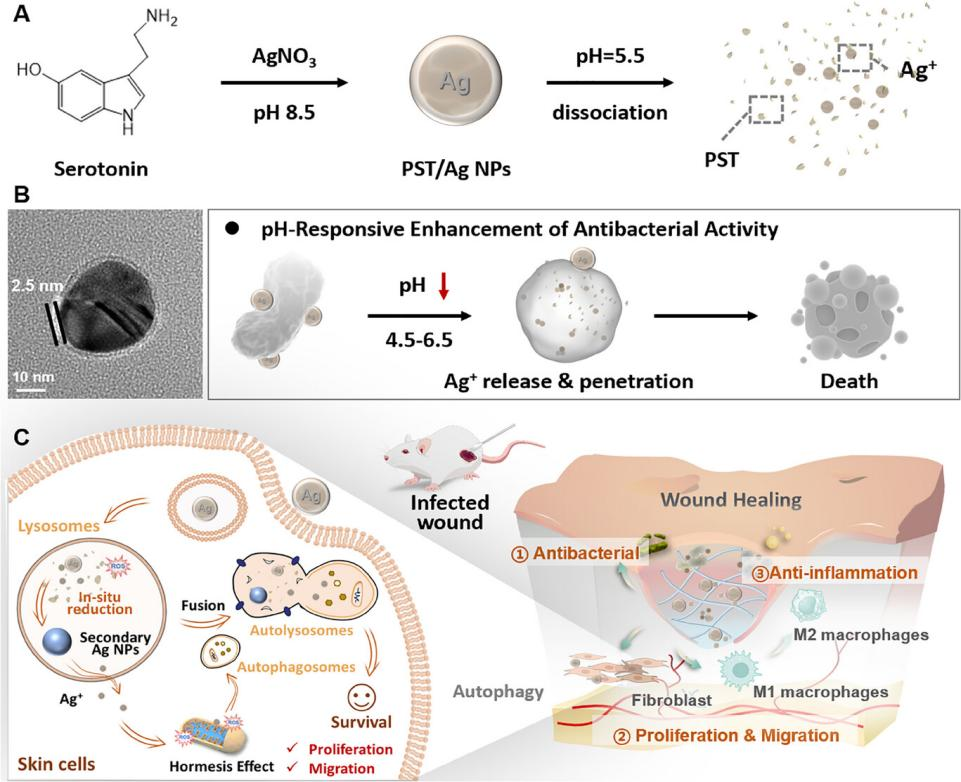
研究以5-羟色胺(serotonin, 5-HT)为原料,利用其在碱性条件下的自氧化聚合能力原位还原银离子,合成包覆有聚羟色胺(PST)壳层的银纳米颗粒。该壳层在感染部位的弱酸性环境下快速降解,释放Ag⁺,从而增强局部抗菌活性;而在正常细胞微环境中则稳定存在,减少Ag⁺泄露,显著降低细胞毒性。该研究首创pH响应型核壳纳米银(PST/Ag),通过"辨微环境而施治"的智能策略,实现了"精准抗菌-微环境重编程-自噬激活"的多级协同治疗,为复杂感染创面提供了突破性解决方案。
邬麟团队发表一项由研究者发起的关于信迪利单抗联合化疗方案一线治疗广泛期小细胞肺癌(ES-SCLC)的临床研究成果
近日,湘雅医学院附属肿瘤医院邬麟教授作为共同第一作者,在Nature子刊《Signal Transduction and Targeted Therapy》(中科院一区,2024IF= 52.7)上发表了一篇题为“Harnessing local and system immune profiling delineating differential responders to first-line sintilimab (anti-PD-1 antibody) combined with chemotherapy in extensive-stage small cell lung cancer: an exploratory biomarker analysis of a phase II study(利用局部和系统免疫特征来分析广泛期小细胞肺癌中一线信迪利单抗(抗PD-1抗体)联合化疗的不同反应者:II期研究的探索性生物标志物分析)”的原创性研究论文。
该研究结果表明,信迪利单抗联合化疗方案在ES-SCLC患者中表现出显著的抗肿瘤活性,中位PFS和OS分别为6.9个月和17.1个月,且不良反应耐受良好。此外,研究团队开发的基于外周血蛋白组学的无创免疫疗效预测模型,能够准确预测接受免疫治疗的ES-SCLC患者的治疗获益情况(High risk vs Low risk, PFS: 5.4m vs 10.0 m, P<0.001; High risk vs Low risk, OS: 15.7m vs NR, P=0.010),并在独立队列进行了验证(High risk vs Low risk, PFS: 5.4m vs 6.8m, P=0.084)。与以往的模型相比,该模型仅需利用基线外周血样本即可进行检测,因此更加适合临床应用推广。这项研究为广泛期小细胞肺癌的精准分层治疗及临床应用提供了新的视角和有力的工具。

原文链接:http://dx.doi.org/10.1038/s41392-025-02252-5
欧阳取长团队发表Trop2ADC药物Sac-TMT对标准治疗耐药的不能手术局部晚期或转移性实体瘤的I/II期临床研究结果
近日,湘雅医学院附属肿瘤医院欧阳取长教授作为第一作者,该院作为第一单位在《Journal of Hematology&Oncology》(中科院一区,2024IF=40.4)发表了题为“Results of a phase 1/2 study of sacituzumab tirumotecan in patients with unresectable locally advanced or metastatic solid tumors refractory to standard therapies(Trop2ADC药物Sac-TMT对标准治疗耐药的不能手术局部晚期或转移性实体瘤的I/II期临床研究”的原创性论文。
这是国内首个Trop2ADC药物Sac-TMT对标准治疗耐药的不能手术的局部晚期或转移性三阴性乳腺癌或HR+/HER2-乳腺癌的I/II期临床研究结果。I期Sac-TMT采用剂量2-12mg/kg的爬坡方式,II期为剂量扩展阶段,5-mg/kg组的三阴性乳腺癌ORR为38.9%,HR+/HER2−乳腺癌的ORR为31.7%,且安全性良好,主要不良反应为口腔炎,皮疹和瘙痒。Sac-TMT显示出可处理的毒性和在三阴性乳腺癌和HR+/HER2−乳腺癌的良好的抗肿瘤活性,目前正在开展III期研究。

原文链接:http://dx.doi.org/10.1186/s13045-025-01705-2
罗嘉团队发表靶向药物联合免疫治疗组对比对照组一线治疗不可切除肝细胞癌的III期临床研究成果
近日,湘雅医学院附属肿瘤医院罗嘉教授作为共同第一作者在国际顶级医学期刊《Lancet Oncology》(中科院一区,2024IF=35.9)上发表了题为“Anlotinib plus penpulimab versus sorafenib in the frst-inetreatment of unresectable hepatocellular carcinoma(APOLL0): a randomised,controlled, phase 3 trial(靶向药物联合免疫治疗组对比对照组一线治疗不可切除肝细胞癌(APOLLO):一项随机、对照、III期研究)”的原创性研究论文。
APOLLO研究由樊嘉院士、周俭教授牵头,包括罗嘉教授团队在内的中国79家中心共同参与完成。本研究自2020年8月至2023年6月,共纳入649例不可切除肝细胞癌受试者,按照2:1的比例随机分配至靶向和免疫药物联合治疗组和对照组。APOLLO研究中,联合治疗组的受试者,中位生存时间为16.5个月,明显优于对照组的13.2个月,降低了31%的死亡风险(P = 0.0014);中位无进展生存时间分别为6.9对比2.8个月,降低了48%的疾病进展风险(P < 0.0001)。本研究成果,有望助力这一联合治疗方案获得国家药品监督管理局批准上市,将来在临床应用于不可切除肝细胞癌的一线治疗,为此类患者带来福音。

原文链接:http://dx.doi.org/10.1016/S1470-2045(25)00190-1
侯静团队发表基于CT扫描检测和诊断骨转移的一种临床应用的人工智能系统的临床研究成果
近日,由湘雅医学院附属肿瘤医院于小平教授团队的侯静教授作为共同第一作者在柳叶刀子刊《NATURE COMMUNICATIONS》(中科院一区,2024IF=15.7)发表了题为“A clinically applicable AI system for detection and diagnosis of bone metastases using CT scans(基于CT扫描检测和诊断骨转移的一种临床应用的人工智能系统)”的原创性研究论文。
骨转移是癌症晚期常见且严重的并发症,其准确检测和诊断对患者的治疗和预后至关重要。传统诊断方法如X线、骨扫描、CT、MRI等存在一定的局限性。本研究使用2518例患者(骨转移灶:9177,非骨转移灶:12824)的CT图像数据对AI系统进行训练,涵盖了不同癌症类型、不同部位的骨转移病例,确保系统的多样性和广泛适用性。结果显示该系统在平扫CT中检测骨病变的敏感性为89.1%,在内部和外部测试集上对骨转移/非骨转移病灶的分类准确率分别为92.3%和91.1%,病变检出率优于放射科医师。该AI系统在检测和诊断骨转移方面表现出良好的性能,具有较高的准确性和敏感性,有望成为临床实践中一种有效的辅助工具。随着技术的进一步完善和优化,该AI系统有望在更多的医疗机构得到广泛应用,推动骨转移诊断领域的智能化发展。

原文链接:http://dx.doi.org/10.1038/s41467-025-59433-7




